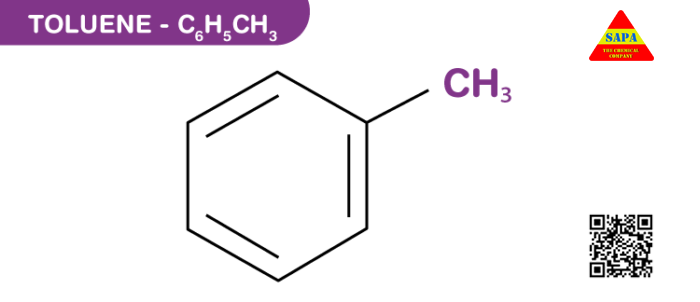
Toluene là gì?
Toluene là một hợp chất tự nhiên có nguồn gốc chủ yếu từ dầu mỏ hoặc quá trình hóa dầu. Toluene là một thành phần phổ biến trong xăng, keo và các sản phẩm sơn. Toluene là một chất lỏng, không màu, không tan trong nước và có mùi giống như chất pha loãng sơn. Nó là một chất lỏng không màu được thay thế đơn chức, bao gồm một nhóm CH3 được gắn với một nhóm phenyl.
{tocify} $title={Nội dung bài viết} |
| Toluene. Ảnh minh họa |
Thuộc tính của Toluene
Toluen có khả năng phản ứng điện cực mạnh hơn benzen . Do phần lớn nhóm metyl hơn tính chất giải phóng electron nên phản ứng thơm bình thường ở cùng vị trí. Nó phải đối mặt với quá trình sulfo hóa để cung cấp một axit gọi là p-toluenesulfonic và clo hóa bằng Cl 2 với sự có mặt của FeCl 3 để tạo ra các đồng phân ortho và para của clorotoluen.
| Công thức hóa học của Toluene | C 6 H 5 CH 3 |
|---|---|
| Điểm sôi của Toluene | 111 ° C |
| Điểm nóng chảy của Toluene | −95 ° C |
| Mật độ của Toluene | 0,87 g / mL |
| Trọng lượng phân tử của Toluene | 92,141 g / mol |
Cấu trúc toluene
Toluene được sử dụng rộng rãi như một nguyên liệu thô công nghiệp và một dung môi để sản xuất nhiều sản phẩm thương mại, bao gồm cả sơn và keo dán.
Sản xuất Toluene
Toluene được tìm thấy tự nhiên trong dầu thô và như một sản phẩm phụ trong quá trình sản xuất xăng. Ngoài ra, nó được thu nhận như một sản phẩm phụ trong quá trình sản xuất than cốc từ than đá.
Sản xuất Toluene ở cấp độ công nghiệp không tốn kém. Nó được tổng hợp theo nhiều phương pháp khác nhau. Ví dụ, phản ứng của benzen với metyl clorua với sự có mặt của nhôm clorua (axit Lewis) để tạo ra toluen:
C 6 H 5 H + CH 3 Cl → C 6 H 5 CH 3 + HCl
Sử dụng Toluene
Toluen được sử dụng rộng rãi như một tiền chất của benzen. Phương trình hóa học của phản ứng giữa toluen và khí hiđro có thể được viết như sau.
C 6 H 5 CH 3 + H 2 → C 6 H 6 + CH 4
Trong khi ứng dụng được sử dụng nhiều thứ hai liên quan đến nó không tương xứng với hỗn hợp benzen và xylen.
Toluene là tiền chất của các hóa chất khác
Cùng với quá trình tổng hợp benzen và xylen , toluen được sử dụng trong sản xuất các chất sau
- Bọt polyurethane
- Trinitrotoluene - Chất nổ
- TNT
- Thuốc tổng hợp.
Toluene như một dung môi
Toluene là một dung môi phổ biến được sử dụng cho những việc sau:
- Keo
- Sơn
- Chất pha loãng sơn
- Mực in
- Cao su
- Thuộc da
- Chất trám silicone
- Chất phản ứng hóa học
- Lacquers
- Thuốc sát trùng.
Các ứng dụng khác của Toluene
Nó có thể được sử dụng trong động cơ đốt trong làm nhiên liệu xăng.
Các ứng dụng Niche của Toluene
Nó được sử dụng làm dung môi cho vật liệu nano cacbon, ống nano và fulleren.
Câu hỏi thường gặp
1. Toluen được dùng để làm gì?
Toluene được sử dụng làm dung môi trong nhiều sản phẩm tiêu dùng và được sử dụng trong chất pha loãng sơn, chất tẩy sơn móng tay, keo dán và chất lỏng sửa chữa. Toluene có nhiều ứng dụng trong các ngành công nghiệp khác nhau. Hợp chất dễ cháy nổ được gọi là TNT hoặc trinitrotoluen rất quan trọng trong ngành công nghiệp chất nổ.
2. Toluen có tan trong nước không?
Toluen không tan trong nước. Toluene được tạo thành từ carbon và hydro, và độ phân cực của nó rất nhỏ.
3. Toluen có mùi gì?
Toluen là một dẫn xuất hydrocacbon thơm của benzen được thế metyl, tồn tại dưới dạng chất lỏng dễ bay hơi trong suốt, không màu và có mùi hăng, giống benzen. Toluen không hòa tan trong nước nhưng có thể trộn lẫn với các dung môi hữu cơ khác.
4. Toluen thuộc nhóm chức nào?
Toluen là thành phần toluen đơn giản nhất của lớp bao gồm lõi benzen chứa một nhóm thế metyl duy nhất. Nó là một phần của toluen và metylbenzen, một hợp chất hữu cơ dễ bay hơi.
5. Có bao nhiêu liên kết sigma trong toluen?
Vòng benzen bao gồm 12 liên kết sigma và 3 liên kết pi, và nhóm thế, metyl, có 3 liên kết sigma. Do đó, toluen (C6H5CH3) có 15 liên kết sigma và 3 liên kết pi.